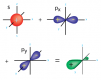
Hibridación de orbitales atómicos
Interacciones de orbitales atómicos dentro de un átomo para formar nuevos orbitales híbridos.|
Pregunta
|
Respuesta correcta
|
¿Qué es la hibridación del carbono? :
|
Conjunto de electrones del mismo nivel de energía |
¿Quién se dedicó a su estudio? :
|
Chester Pinker |
¿Qué nos permite demostrar la hibridación? :
|
La geometría y propiedades de algunas moléculas |
¿Cuántos tipos de hibridación existen? :
|
3 tipos |
¿En qué consiste la hibridación SP3? :
|
La unión de un orbital S con tres orbitales P. |
¿ Cuál es su ángulo de enlace ? :
|
109,5° |
¿Por qué a estos nuevos orbitales se los llama SP3? :
|
Porque tienen un 25% de carácter S y 75% de carácter P. |
Gracias al proceso de hibridación SP3 se explica..... :
|
La tetravalencia del átomo de carbono. |
|
Pregunta
|
Respuesta correcta
|
Hibridación SP2: se define como la combinación de un orbital S y_, para formar _ orbitales híbridos. :
|
2P-3 |
Los átomos que forman hibridaciones SP2 pueden formar compuestos con enlances __ :
|
Dobles |
Hibridación SP2: su molécula es de forma..... :
|
Plana |
Hibridación SP2: los enlaces dobles están compuestos por un enlace__ y un enlace__ :
|
Sigma-π |
Hibridación SP1:se define como la combinación de un orbital_ y un _,para formar_ orbitales híbridos :
|
S-P-2 |
Hibridación SP1: este es el tipo de enlace híbrido, con un ángulo de _° :
|
180° |
Hibridación SP1: se encuentran existentes en compuestos con triples enlaces como los.... :
|
Alquinos |
Hibridación SP1: se caracteriza por la presencia de_ enlaces_ :
|
2-π |
Otros juegos similares:
Otros juegos similares:
Otros juegos similares: